Intsel Chimos est spécialisé dans la distribution d’accès précoce et compassionnel, en apportant son expertise aux laboratoires pharmaceutiques qui souhaitent mettre à disposition des patients des nouvelles thérapies. — aussi bien avant qu’après leur autorisation de mise sur le marché.
Usage compassionnel
Pour les patients atteints de maladies graves ou potentiellement mortelles sans alternative thérapeutique, l’usage compassionnel constitue une voie d’accès essentielle à des traitements prometteurs encore en cours de développement.
Les Autorisations d’Accès Compassionnel (AAC) sont accordées par l’ANSM au cas par cas pour un patient défini, en dehors des essais cliniques et sur demande d’un professionnel de santé.
Notre rôle dans l’usage compassionnel :
Logistique & approvisionnement : Nous sourçons et assurons la livraison sécurisée et rapide des produits pharmaceutiques.
Programmes d’accès précoce (AAP : AP1 & AP2)
L’Autorisation d’Accès Précoce (AAP) permet à des patients atteints de maladies graves ou rares d’accéder à des médicaments innovants avant leur mise sur le marché en droit commun, et sur engagement du laboratoire titulaire à déposer un dossier de demande d’AMM.
Notre rôle dans l’accès précoce :
Collecte de données : Nous contribuons à la collecte de données en vie réelle sur l’efficacité et la sécurité des traitements.

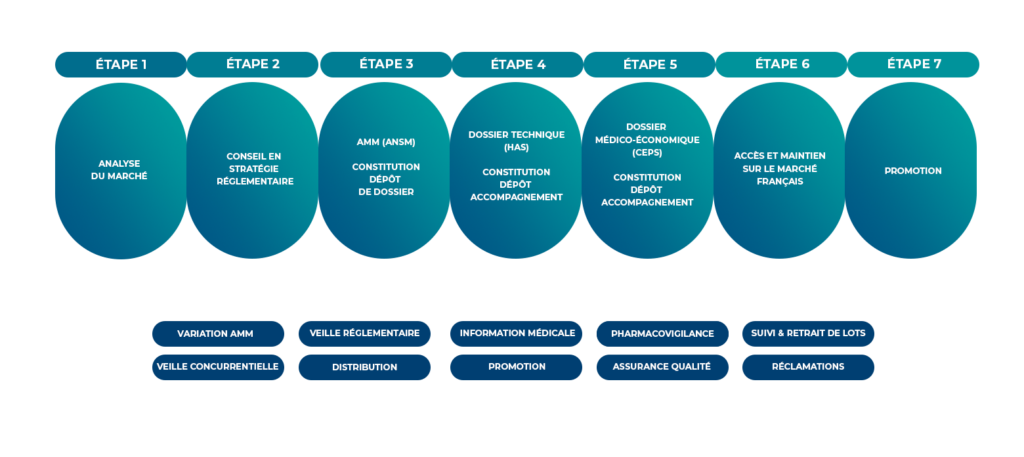
Une approche stratégique et une analyse approfondie du marché sont essentielles pour réussir l’introduction d’un médicament sur le marché. Cette stratégie doit être anticipée bien avant le lancement du produit, qu’il s’agisse d’un accès précoce ou d’un médicament bénéficiant d’une autorisation de mise sur le marché. Elle comprend notamment la veille concurrentielle, les négociations de prix, la demande de remboursement et les évaluations médico-économiques.
Notre rôle dans l’accès au marché :
Intsel chimos vous accompagne à toutes les étapes d’accès au marché français.


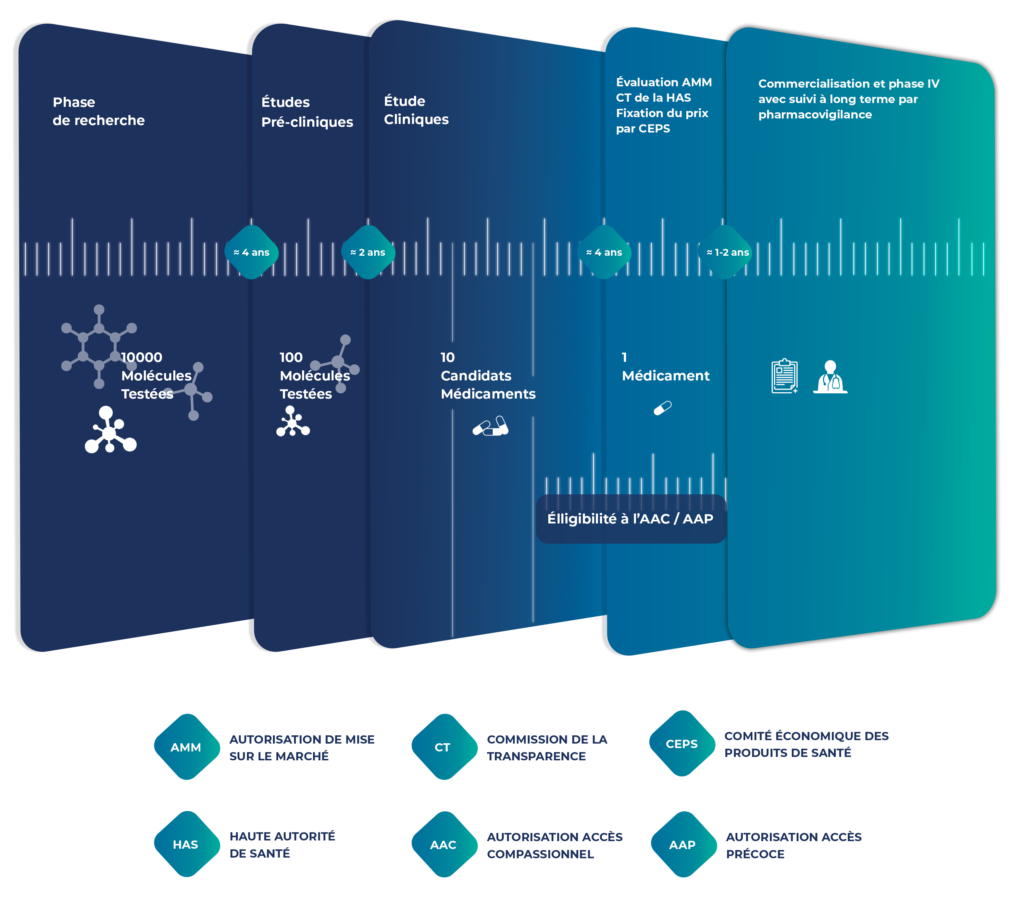
Chez Intsel Chimos, nous facilitons la mise en œuvre des essais cliniques, en garantissant une collecte et une gestion rigoureuses des données, afin de valider l’efficacité et la sécurité des futurs traitements en conditions réelles.
Nos services s’adaptent aux exigences spécifiques de chaque étude, en conformité totale avec le Règlement Général sur la Protection des Données (RGPD).
Gestion des données
La collecte et la gestion précises des données sont essentielles pour préserver l’intégrité d’un essai clinique et/ou démontrer l’efficacité et la sécurité d’un traitement dans le cadre d’un programme d’accès encadré.
Nous utilisons des systèmes de capture électronique des données (plateforme EDC) afin d’assurer une saisie, une validation et un suivi en temps réel.
Nos pratiques de gestion des données sont alignées sur les normes réglementaires, garantissant ainsi l’exactitude, l’exhaustivité et la traçabilité des informations.
Distribution dans le cadre des essais cliniques
Nous assurons un service complet de distribution dans le cadre des essais cliniques, en garantissant une livraison rapide et conforme des produits en investigation.

| Cookie | Durée | Description |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |